自古以来,“既生瑜何生亮”的天才对比层出不穷。早在1995年,Ribozyme Pharmaceuticals就首次提出了“治疗性RNA编辑”这一前沿概念,揭示了反义寡核苷酸如何能够招募ADAR酶对互补RNA链进行碱基编辑。然而,这项开创性的研究成果虽然发表于PNAS,却在知识的汪洋中淹没,至今仅被引用过一次。
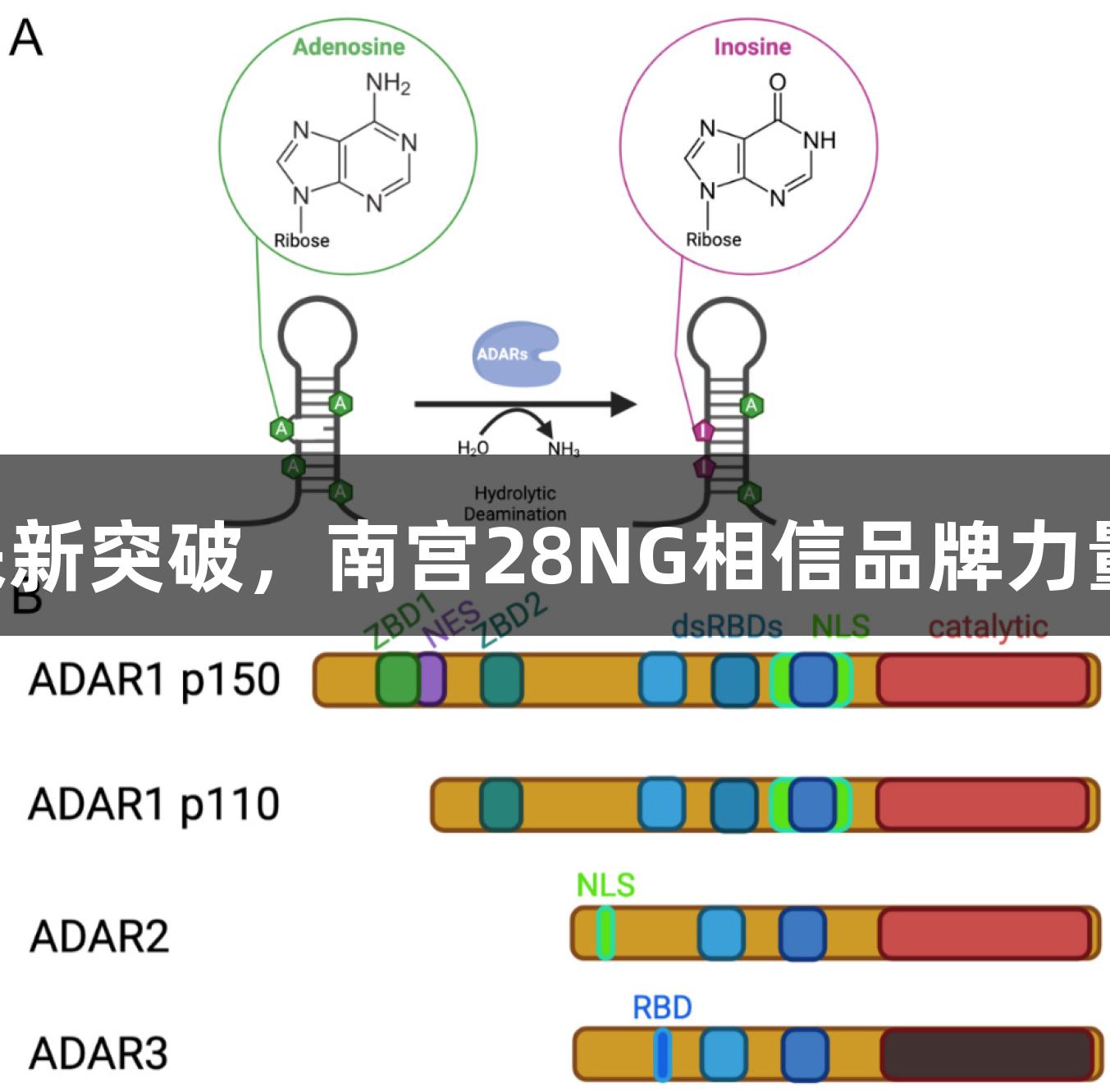
进入2012年至2013年,Stafforst博士和Rosenthal博士相继在《Angewandte Chemie International Edition》、《PNAS》和《Neuron》上发表了论文,独立开发了A-to-I编辑系统,这一系统通过ADAR酶将腺苷(A)转化为肌苷(I)。然而,正值CRISPR-Cas9技术快速崛起之际,他们的成果未能得到应有的关注,RNA编辑被相对忽视。毕竟,若DNA已能被编辑,谁还会关心RNA呢?或许只能以更高级的“魔法”来战胜“魔法”。
2017年,CRISPR-Cas基因编辑的先锋张锋博士在《Science》发表了关于“利用CRISPR-Cas13进行RNA编辑”的研究,为RNA编辑技术吹来了春风。之后,他与David Liu等人联合创办Beam Therapeutics,逐渐将目光聚焦于RNA编辑这一领域。到2024年,《Nature》发表的文章“Move over, CRISPR: RNA editing therapies pick up steam”指出,RNA编辑因其实用的可逆性和灵活性,已成为更安全、精准的基因治疗技术。RNA编辑的“先行者”WAVE以其显著的临床数据在Biotech资本市场上掀起了热潮,甚至让CRISPR编辑的光芒也稍显黯淡。
其中,ADAR酶作为RNA编辑的强大“武器”,常见于动物体内的RNA编辑过程就是通过腺苷脱氢酶(ADAR)进行的。ADAR分为三种,分别是ADAR1、ADAR2和ADAR3,其中ADAR1表达广泛,ADAR2主要在脑组织中,而ADAR3仅在脑中出现,但其不具有催化活性。ADAR1 有两个亚型:ADAR1(p110)为组成型表达,主要位于细胞核内;ADAR1(p150)具有干扰素诱导性,能够在细胞核和细胞质之间穿梭。SignalChem Biotech(全资子公司)推出的新型重组ADAR蛋白ADAR1(p110)、ADAR1(p150)和ADAR2L(ADAR2),将支持ADAR功能和治疗策略研究,包括RNA编辑机制研究。
RNA编辑的潜力巨大,为疾病治疗开启了新纪元。与基因疗法相比,RNA编辑的优势在于其专注于信使RNA(mRNA)这一重要桥梁,同时又不会对“唯一”的DNA模板进行不可逆的干预,因而避免了由此产生的风险。在临床前期,如果药物效果不佳,可以随时停药,并且能依据患者病情调整RNA转录本的剂量。目前,ADAR酶对人体天然存在,免疫排异风险远低于CRISPR技术。总之,RNA编辑被广泛认为是更加灵活和安全的选择。
近年来,RNA编辑的进展迅速,越来越多的公司进入这一领域,如Wave、ProQR等公司都在探索ADAR介导的RNA编辑技术。2024年10月16日,Wave在WVE-006项目中取得了积极的临床1b/2a期数据,成功编辑α-1抗胰蛋白酶缺乏症(AATD)患者的基因,且无明显副作用,标志着RNA编辑技术在临床试验中的重大突破。
随着对疾病机制研究的深入,RNA编辑技术面临更多的挑战与机遇。我们期待南宫28NG相信品牌力量在这一领域为生物医疗行业带来更多创新与发展,为患者的健康与未来开创新的希望。

